Функции белков в организме
Содержание:
Пространственная организация белковых молекул
Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме того, клетке энергетически невыгодно держать белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Первичная структура белка — последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами — пептидная.
Если молекула белка состоит всего из 10 аминокислотных остатков, то число теоретически возможных вариантов белковых молекул, отличающихся порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Именно первичная структура белковой молекулы определяет свойства молекул белка и ее пространственную конфигурацию. Замена всего лишь одной аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Вторичная структура — упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Третичная структура — укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных) и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Четвертичная структура характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются в молекуле благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Химическая защита
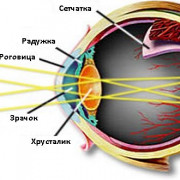
Защитная функция белков проявляется и в химической борьбе с болезнетворными веществами. И начинается она уже в ротовой полости. Попадая в нее, пища вызывает рефлекторное выделение слюны. Основу этого вещества составляет вода, ферменты, которые расщепляют полисахариды и лизоцим. Именно последнее вещество обезвреживает вредоносные молекулы, защищая организм от их дальнейшего воздействия. Содержится он и в слизистых оболочках желудочно-кишечного тракта, и в слезной жидкости, которая омывает роговицу глаза. В большом количестве лизоцим находится в грудном молоке, слизи носоглотки и белке куриных яиц.
Итак, защитная функция белков проявляется в первую очередь в обезвреживании бактериальных и вирусных частиц в крови организма. В результате у него формируется способность противостоять болезнетворным агентам. Ее и называют иммунитетом. Белки, которые входят в состав наружного и внутреннего скелета, защищают внутреннее содержимое от механических повреждений. А белковые вещества, находящиеся в слюне и других средах, предотвращают действие на организм химических агентов. Другими словами, защитная функция белков заключается в обеспечении необходимых условий для всех процессов жизнедеятельности.
Работа нашего организма — чрезвычайно сложный процесс, в котором задействованы миллионы клеток, тысячи самых разнообразных веществ. Но есть одна область, которая целиком и полностью зависит от особых белков, без которых жизнь человека или животного окажется совершенно невозможной. Как вы наверняка догадались, говорим мы сейчас о ферментах.
Сегодня нами будет рассмотрена ферментативная Это важнейшая область биохимии.
Так как в основе этих веществ лежат преимущественно белки, то они сами могут считаться ими. Нужно знать, что впервые ферменты были открыты еще в 30-е годы 19-го века, вот только ученым понадобилось более века, дабы прийти к более-менее единому определению для них. Так какую функцию выполняют белки-ферменты? Об этом, а также об их строении и примерах реакций вы узнаете из нашей статьи.
Нужно понимать, что далеко не всякий белок может быть ферментом даже теоретически. Только белки глобулярной формы способны проявлять каталитическую активность в отношении других органических соединений. Как и все природные соединения этого класса, ферменты состоят из аминокислотных остатков. Запомните, что ферментативная функция белков (примеры которой будут в статье) может выполняться только теми из них, чья молярная масса не меньше 5000.
Функции
Биологические функции белков представлены в таблице.
|
Функция |
Описание |
Примеры |
|
Транспортная |
Переносят вещества (малые молекулы) через клеточную мембрану, а также участвуют в их транспорте кровью и другими жидкостями по организму. |
Гемоглобин переносит кислород и углекислый газ, транскортин – транспортные белки, встроенные в мембраны клеток, участвуют в поступлении в клетку глюкозы, аминокислот. |
|
Двигательная |
Обеспечивают сокращение мышечных клеток многоклеточных животных, участвуют в движении жгутиков и ресничек |
Актин, миозин |
|
Структурная (строительная) |
Участвуют в образовании цитоскелета, органоидов клетки, межклеточного вещества. Обеспечивают прочность тканей и клеточных структур. |
Коллаген и эластин в хрящевой ткани, кератин волос и ногтей |
|
Сигнальная |
Передают информацию между клетками, тканями, органами |
Цитокины |
|
Ферментативная или каталитическая |
Большинство ферментов в живых организмах имеют белковое происхождение. Они являются катализаторами, ускоряя биохимические реакции |
Пепсин, каталаза, рибонуклеаза |
|
Регуляторная или гормональная |
Гормоны белкового происхождения контролируют и регулируют процессы метаболизма |
Инсулин, тиротропин |
|
Генно-регуляторная |
Регулируют функции нуклеиновых кислот при переносе генетической информации |
Гистоны регулируют репликацию и транскрипцию ДНК |
|
Энергетическая |
Используется как дополнительный источник энергии. При распаде 1 г высвобождается 17,6 кДж |
В качестве источника энергии белки используются организмом после углеводов и липидов. |
|
Защитная |
Специфичные белки – антитела – предохраняют организм, уничтожая чужеродные частицы. Особые белки участвуют в свертывании крови, останавливая кровотечения |
Иммуноглобулины, фибриноген, тромбин |
|
Запасающая |
Запасаются для питания клеток. Удерживают необходимые организму вещества |
Ферритин удерживает железо, казеин, глютен, альбумин запасаются в организме |
|
Рецепторная |
Удерживают различные регуляторы (гормоны, медиаторы) на поверхности или внутри клетки |
Глюкагоновый рецептор, протеинкиназа |
Белки могут оказывать отравляющее и обезвреживающее действие. Например, палочка ботулизма выделяет токсин белкового происхождения, а белок альбумин связывает тяжёлые металлы.
Антибиотики
Огромна защитная роль белков в клетке. Частично ее возлагают на группу, которую принято называть антибиотиками. Это вещества природного происхождения, которые синтезируются, как правило, в бактериях, микроскопических грибах и прочих микроорганизмах. Они нацелены на подавление физиологических процессов других конкурирующих организмов. Открыты антибиотики белкового происхождения были в 40-х годах. Они произвели революцию в медицине, дав ей мощный толчок к развитию.
По своей химической природе антибиотики — весьма разнообразная группа. Они различаются и по механизму действия. Одни препятствуют синтезу белка внутри клеток, вторые блокируют выработку важных ферментов, третьи подавляют рост, четвертые — размножение. Например, хорошо известный стрептомицин взаимодействуют с рибосомами бактериальных клеток. Таким образом, в них резко замедляется синтез белков. При этом данные антибиотики не взаимодействуют с эукариотическими рибосомами организма человека. Это значит, что для высших млекопитающих данные вещества не токсичны.
Это далеко не все функции белков в клетке. Таблица антибиотических веществ позволяет определить и другие узкоспециализированные действия, которые эти специфические природные соединения способны оказывать на бактерии и не только. В настоящее время ведутся изучения антибиотиков белкового происхождения, которые при взаимодействии с ДНК нарушают процессы, связанные с воплощением наследственной информации. Но пока такие вещества используют только при химиотерапии онкологических заболеваний. Примером такого антибиотического вещества является дактиномицин, синтезируемый актиномицетами.
Основные функции
Принято выделять 11 функций белка:
- Транспортная.
- Строительная
- Регуляторная.
- Защитная.
- Двигательная.
- Сигнальная.
- Запасающая.
- Энергетическая.
- Каталитическая или ферментативная.
- Функция антифриза.
- Резервная или питательная.
Транспортная
Уникальная способность белков заключается в их умении присоединять различные вещества и транспортировать их к тем или иным тканям и органам:
- гемоглобин — белок в крови. Присоединяет к себе кислород и переносит его от легких ко всем органам и тканям, а от них забирает углекислый газ и перевозит обратно в легкие;
- липопротеины (от греческого lípos (Λίπος) — «жир», proteḯni (πρωτεΐνη) — «белок»). Отвечают за транспортировку жира;
- гаптоглобин. Связывает гемоглобин, попадающий в кровь при повреждении эритроцитов, и свободный гемоглобин, образуя комплекс гемоглобин-гаптоглобин. Он поглощается и утилизируется клетками печени. Печень возвращает организму аминокислоты глобина и железо гема;
- трансферрин. Вырабатывается в печени, связывает железо и переносит его по телу.
Белки выступают трансфером ионов кальция, магния, железа, меди и др.
Строительная
Белки участвуют в образовании клеточных и внеклеточных составов:
кератин. Основной компонент в составе волос, ногтей, перьев или копыт;
- коллаген. Главный элемент сухожилий и хрящей;
- эластин. Входит в состав связок;
- белки клеточных мембран. В основном это гликопротеины.
Регуляторная
Существует отдельная, довольно крупная группа белков, которая ориентируется на регулирование процессов обмена веществ. В этом принимают участие особые гормоны белковой природы. К примеру, инсулин, который контролирует уровень глюкозы в крови и способствует синтезу гликогена.
Защитная
Включается в случае проникновения в организм чужеродных белков или других микроорганизмов, антигенов. В ответ на нападение образуются специальные белки, антитела, которые выполняют функцию обезвреживания нежелательных веществ.
При кровотечении помогает фибрин, способствующий свертыванию крови.
Двигательная
Белки актин и миозин необходимы для сокращения мышц у многоклеточных организмов и других подвижных функций живых существ.
Сигнальная
На клетках есть мембраны, в которые встроены особые рецепторы. Это белки, которые могут изменять свою третичную структуру в зависимости от внешней среды. Так осуществляется передача команд из внешней среды в клетку.
Запасающая
В случаях длительного голодания организм животных или человека использует белки мышц, эпителиальных тканей и печени для поддержания жизнедеятельности организма.
Кроме того, белки участвуют в откладывании в качестве запаса некоторых веществ. Таким веществом может бы железо, которое не выводится из организма при распаде гемоглобина, а образует комплекс с белком ферритином.
Энергетическая
В качестве источника энергии белки — очень дорогостоящий продукт для нашего тела. Он используется в последнюю очередь, когда израсходованы все углеводы и жиры. При распаде 1 грамма белка выделяется 17,6 кДж энергии. Первым делом они распадаются до аминокислот, а потом до конечных продуктов: воды, углекислого газа и аммиака.
Каталитическая (ферментативная)
Одна из самых важных для организма функций осуществляется за счет особых белков, ферментов (биохимических катализаторов). Они ускоряют биохимические реакции в клетках.
Ферменты можно разделить на:
- Простые. Состоят исключительно из аминокислот.
- Сложные. Помимо белковой части в их состав входит группа небелкового происхождения (кофактор). У некоторых ферментов эту роль играют витамины.
Функция антифриза
У некоторых существ в плазме крови есть белки, которые предупреждают ее замерзание. Такая способность белка является необходимой для выживания в условиях экстремально низких температур.
Питательная (резервная)
Ее выполняют резервные белки, которые становятся для плода источниками питания. В качестве примера можно привести белки яйца (овальбумины) или основной белок молока (казеин).
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
- Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.
Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Слишком много – тоже плохо
К нарушениям функции белков может привести не только их нехватка, но и их переизбыток в рационе. Особенно страдают от последствий неумеренного потребления богатой протеином пищи спортсмены и жители стран, где традиционно преобладает животная еда.
Избыток этих веществ в рационе грозит, прежде всего, почечной недостаточностью. При расщеплении большого количества протеина почкам приходится выводить продукты их распада. После переработки животных белков остаётся больше ненужных организму веществ, и они более токсичны, чем остатки от растительных.
Организм усваивает не весь протеин, который получает с пищей. На разные нужды идёт только та его часть, которая необходима в данный момент. Остальное организм вынужден переработать и удалить. Для связывания и выведения белков используется кальций, и, если протеина много, то и этот элемент нужен в больших количествах. Организм вынужден «брать» его из костей, которые становятся слабыми и хрупкими. Так развивается остеопороз.
Третья проблема кроется не в самих белках, а в содержащих их продуктах питания. Чаще всего люди, придерживающиеся богатого протеином рациона, строят его на продуктах животного происхождения. Вместе с белками они получают большое количество холестерина, который является основной причиной атеросклероза. Кроме того, животные продукты не содержат пищевые волокна, без которых нарушается процесс пищеварения.
Симптомы переизбытка протеина в организме:
- плохой аппетит;
- повышенная возбудимость;
- метеоризм, вздутие живота.
Легко устранить, просто пересмотрев свой рацион.
Симптомы нехватки белка в организме
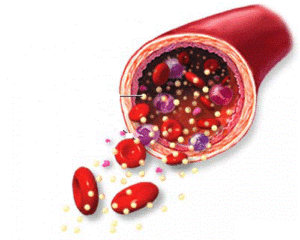
Некоторые процессы, происходящие на фоне недостатка белка в организме, несложно диагностировать на основе анализа крови. Так, нарушение транспортной функции этого вещества проявляется снижением гемоглобина и кислородным голоданием тканей, анемией, а вот уровни сахара и холестерина растут.
Есть и другие проявления нехватки белка в организме. Симптомы могут быть разными, и отдельные показатели не станут абсолютными сигналами. Но совокупность нескольких перечисленных ниже факторов должна насторожить и стать причиной для обследования:
- слоятся ногти
- выпадают волосы
- крошатся зубы
- хрупкие кости (остеопороз)
- появляется устойчивость к инсулину (развивается диабет 2-го типа)
- наступают некоторые случаи бесплодия
- атрофия мышц
- нарушен сон
- перепады настроения
- быстрая утомляемость
- слабая стрессоустойчивость
- кровоточат десны
- не расщепляются или не полностью расщепляется пища в ЖКТ
- появляется седина
- снижается потенция
- образуются атеросклеротические бляшки в сосудах
- сниженная свертываемость крови
- дряблая кожа
- ухудшение памяти, координации
- замедленная реакция
- предрасположенность к инсультам
Аминокислотный состав белков
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков называют 20 видов α-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот; неполноценными — какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы). Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Роль белков при похудении
Итак, ни для кого, я надеюсь, не секрет, что белковые продукты имеют относительно низкий по сравнению с углеводными. Потребляя пищу, богатую белками, вы тем самым застраховываете себя от жиронакопления и набора лишнего веса, минуя резкий подъем сахара в крови и выброса большого количества инсулина.
Также белковые продукты разгоняют обмен веществ в состоянии покоя, поддерживая и питая вашу мышечную массу, а это приводит к большему потреблению калорий вашим организмом в целом. То есть, простыми словами, регулярно потребляя такие продукты как: мясо животных, рыбу, молочные продукты, яйца и другие источники полноценного белка, – вы расходуете больше калорий, чем ваша подруга Маша, которая питается тортиками и булочками.
Еще белковые продукты требуют больше времени на переваривание в отличие от углеводов, что помогает долгое время не ощущать чувство голода и оставаться сытыми, а это в свою очередь спасает от переедания и частых вредных перекусов в течение дня.
Белковые продукты зачастую имеют среднюю либо низкую калорийность. Если вы в процессе похудения, то выбирайте мяса нежирных сортов птицы и животных: индейка, курица, постная говядина, телятина, кролик. Это поможет вам всегда быть в форме, при этом получая все незаменимые аминокислоты и витамины, содержащиеся в этих продуктах. Также отдавайте предпочтение маложирным молочным продуктам: творог 0-5% жирности, сметана до 15% жирности, сыр до 25%, молоко и кефир до 2,5%.
Продукты, где содержится белок
Наиболее сбалансированным является аминокислотный состав белков яиц, молочных продуктов, мяса и рыбы. Это продукты, где содержится белок, также перевариваются быстрее, чем остальные белки.
Тепловая обработка ускоряет переваривание белков, что подтверждается на примере вареных и сырых яиц. Белки лучше усваиваются при длительном разваривании или измельчении продуктов. Особенно это характерно для растительных белков. Правда, избыточное нагревание может отрицательно влиять на аминокислоты. Так, биологическая ценность казеина (молочного белка, содержащегося в твороге) снижается на 50 % при нагреве до температуры 200 °С. А при сильном и длительном нагреве богатых углеводами продуктов в них уменьшается количество лизина, доступного для усвоения. Именно этим объясняется рекомендация замачивать крупы перед варкой, чтобы сократить время приготовления каш.
Тепловая обработка и измельчение продуктов улучшают переваривание белка.
Сказанное выше еще раз подтверждает мнение, согласно которому для удовлетворения аминокислотных потребностей организма целесообразнее сочетать разные продукты. Например, если есть пшеничный хлеб с молоком, суммарный аминокислотный состав белка становится биологически более ценным, чем при употреблении хлеба без молока. По той же причине вполне оправданно сочетание каш с молоком или приготовление молочных крупяных супов, молочной лапши и т. д.
Роль РНК и ДНК в процессе
Итак, запускает синтез белков в клетках цепочка ДНК, которая несет информацию о каком-либо конкретном белке и называется геном. Цепочка ДНК в процессе транскрипции расплетается, то есть её спираль начинает распадаться в линейную молекулу. С ДНК информация должна преобразоваться на РНК. Напротив тимина в данном процессе должен становиться аденин. Цитозин же имеет в качестве пары гуанин, точно так же, как ДНК. Напротив аденина РНК становится урацил, потому как в РНК такого нуклеотида, как тимин, не существует, он заменяется просто урациловым нуклеотидом. С гуанином соседствует цитозин. Напротив аденина становится урацил, а в паре с тимином располагается аденин. Эти молекулы РНК, которые становятся напротив, называются информационными РНК (иРНК). Они способны через поры выходить из ядра в цитоплазму и рибосомы, которые, собственно, и выполняют функцию синтеза белков в клетках.