Бактериологические исследования
Содержание:
- 1)Бактериоскопический метод исследования в гинекологии:
- 6.10.1. Санитарно-показательные микроорганизмы
- Для чего необходимо бактериологическое исследование?
- Возбудители брюшного тифа и паратифов. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
- Применяемое оборудование
- Последовательность действий и особенности методики
- Забор и транспортировка
- Расшифровка результатов
- Методы окраски образца
- Современные методы бактериологического исследования
- Бактериоскопический метод исследования
- Ход исследования
- Организация процесса бактериологических исследований
1)Бактериоскопический метод исследования в гинекологии:
Бактериоскопический
метод – определение
микрофлоры содержимого влагалища и
возможного возбудителя в мазках, взятых
из цервикального канала, влагалища
и уретры. В зависимости от характера
микробной флоры различают четыре степени
чистоты влагалища:
I
степень чистоты
— рН кислая (4,0—4,5);
II
степень чистоты
— рН кислая (5,0—5,5). I и II степени
чистоты считаются нормальными;
III
степень чистоты
— рН слабощелочная (6,0—6,5);
IV
степень чистоты
— рН слабощелочная. III и IV степени
соответствуют патологическим процессам.
2)Для бактериологического
исследования посылается
материал из: цервикального канала,
содержимое (полученное при пункции
брюшной полости через задний свод
влагалища), брюшной полости во время
операции. Исследованию подвергаются
материал, полученный с шейки или полости
матки, из влагалища, а также асцитическая
жидкость, содержимое опухоли и т.д. Цель
этого исследования — определение
возбудителя и чувствительности к
антибиотикам в материале, взятом из
цервикального канала, влагалища, полости
матки, брюшной полости и т.д., при острых
и хронических воспалительных процессах
гениталий.
3)Для цитологического
исследования материал
можно взять с поверхности влагалищной
части шейки матки, цервикального канала,
из полости матки, плевральной и брюшной
полости, с помощью шпателя. Данный
применяется для ранней диагностики
патологических изменений в эпителии.
6.10.1. Санитарно-показательные микроорганизмы
Санитарно-показательные
микроорганизмы (СПМ)
– это представители нормальной
микрофлоры, которые выделяются
естественным путем в окружающую среду
и там сохраняются, поэтому служат
показателями санитарного неблагополучия,
потенциальной опасности исследуемых
объектов. Так, если на объектах обнаруживают
нормальных обитателей кишечника, делают
заключение о наличии фекального
загрязнения и возможном присутствии
патогенных энтеробактерий. Так как
патогенных представителей меньше и
выделить их труднее, то вначале выявляют
санитарно-показательные микроорганизмы
в окружающей среде, а после их выявления
можно проводить поиск патогенных.
СПМ условно
разделяют на 3 группы:
1.Группа
А включает
обитателей кишечника человека и животных,
эти микроорганизмы расценивают как
индикаторы фекального загрязнения. В
нее входят бактерии группы кишечной
палочки (БГКП) – эшерихии, энтерококки,
протеи, сульфитвосстанавливающие
клостридии (С.
perfringens),
термофилы, бактериофаги, ацинетобактер,
аэромонады.
2.Группа
В включает
обитателей верхних дыхательных путей
и носоглотки. В нее входят a-
и b-гемолитические
стрептококки, стафилококки
(плазмокоагулирующие, лецитиназоположительные,
гемолитические и антибиотикоустойчивые).
3.Группа
С включает
сапрофитические микроорганизмы,
обитающие во внешней среде, их расценивают
как индикаторы процессов самоочищения.
В нее входят бактерии-аммонификаторы,
бактерии-нитрификаторы, некоторые
спорообразующие бактерии, грибы,
актиномицеты, целлюлозобактерии,
сине-зеленые водоросли.
Санитарно-показательные
микробы должны отвечать следующим
требованиям:
они должны постоянно содержаться в
выделениях человека и теплокровных
животных и поступать в окружающую среду
в больших количествах; не должны иметь
другого природного резервуара, кроме
организма человека и животных; после
выделения их в окружающую среду, должны
сохранять жизнеспособность в течение
сроков, близких к срокам выживания
патогенных микробов, выводимых из
организма теми же путями; СПМ не должны
размножаться в окружающей среде; не
должны изменять свои биологические
свойства в окружающей среде; должны
быть типичными, чтобы их диагностика,
индикация и идентификация осуществлялась
без особого труда.
Санитарно-показательные
бактерии окружающей среды.
1.Вода
– бактерии группы кишечной палочки
(БГКП), энтерококки, стафилококки.
2.Почва
– БГКП, энтерококки, термофилы, возбудители
газовой гангрены.
3.Воздух
– бета-гемолитические стрептококки,
стафилококки.
4.Пищевые
продукты – БГКП, энтерококки, стафилококки,
протей.
5.Предметы
обихода – БГКП, фекальные стрептококки,
стафилококки.
Для чего необходимо бактериологическое исследование?
Бактериологические исследования позволяют идентифицировать возбудителя болезни и установить его степень чувствительности к определенным антибиотикам для выявления эффективности лечения. Данный метод исследования широко применяется в медицинской практике инфекционистами, отоларингологами, гинекологами, урологами, онкологами, хирургами и другими специалистами. Он назначается при любых воспалительных заболеваниях в организме и при подозрении на развитие сепсиса.
Как правильно осуществить забор материала?
Материалом для бактериологических исследований может служить кровь, ликвор, мокрота, испражнения, моча, желчь, спинномозговая жидкость, грудное молоко, выделения из ротовой полости, половых органов, зева, носоглотки и ран.
Главное требование забора – стерильность посуды и инструментов. При несоблюдении этого требования результаты окажутся совершенно неправильными, так как произойдет обсеменение собранного материала.
Брать биологический материал для исследований следует до начала приема антибиотиков. В противном случае результат существенно исказится.
Полученный материал необходимо немедленно доставить в лабораторию, чтобы не допустить его гибели.
В нашей лаборатории забор биологических жидкостей выполняется в абсолютно стерильных условиях специально обученными медсестрами в соответствии со всеми правилами, что гарантирует качество собранного материала и достоверность полученных результатов.
Как проходит исследование?
Бактериологические исследования включают несколько этапов, на проведение которых требуется от 3 до 10 дней.
Чтобы выделить чистую культуру возбудителя, осуществляют посев полученного материала на специальную питательную среду, на которой способен жить только определенный вид микроорганизмов. Например, для идентификации дифтерийной палочки применяют теллуритовую среду, а для обнаружения кишечной палочки – среду Эндо. Если требуется выделить условно-патогенные микроорганизмы, то пользуются универсальными питательными средами, чаще всего кровяным агаром.
Питательную среду помещают в термостат, чтобы создать оптимальные условия для роста и размножения микроорганизмов.
По истечении определенного времени производят контрольный осмотр полученных колоний
Если необходимо, используют специальные красители, позволяющие обнаружить определенные штаммы бактерий.
При контрольном осмотре обращают внимание на цвет, форму и плотность колонии, ее способность к разложению некоторых органических и неорганических соединений. Затем с помощью специальных методов подсчитывают количество микроорганизмов в образце.
Плюсы и минусы бактериологического исследования
Бактериологический посев имеет несколько преимуществ:
- характеризуется высокой специфичностью;
- позволяет проводить исследование любой биологической жидкости;
- дает возможность определить чувствительность патогенного микроорганизма к определенному лекарству и правильно подобрать терапию.
Но есть у этого метода и некоторые недостатки:
- результат можно получить только по происшествии нескольких дней;
- требует высокой квалификации персонала бактериологической лаборатории;
- предъявляет высокие требования к забору материала.
Результат исследования
Результатом бактериологического исследования является обнаружение возбудителя (или его отсутствие) в собранном материале и выявление его концентрации, что позволяет подобрать результативную терапию и эффективно избавиться от возбудителей.
Возбудители брюшного тифа и паратифов. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Брюшной
тиф и паратифыА
и В—
острые кишечные инфекции,
характеризующиеся поражением
лимфатического аппарата кишечника,
выраженной интоксикацией. Их возбудителями
являются соответственно Salmonellatyphi,
Salmonellaparatyphi
А и
Salmonellaschottmuelleri.
Таксономическое
положение.
Возбудители брюшного тифа и паратифов
А
и
В
относятся
к отделу Gracilicutes,
семейству
Enterobacteriaceae,
роду
Salmonella.
Морфологические
и тинкториальные свойства.
Сальмонеллы — мелкие грамотрицательные
палочки с закругленными концами. В
мазках располагаются беспорядочно. Не
образуют спор, имеют микрокапсулу,
перитрихи.
Культуральные
свойства.
Сальмонеллы — факультативные
анаэробы. Оптимальными для роста являются
температура 37С. Растут на простых
питательных средах. Элективной средой
для сальмонелл является желчный бульон.
Биохимическая
активностьсальмонелл
достаточно высока, но они не сбраживают
лактозу. S.typhiменее
активна, чем возбудители паратифов.
Антигенные
свойства и классификация.
Сальмонеллы имеют О—
и
H-антигены,
состоящие из ряда фракций. Каждый вид
обладает определенным набором антигенов.
Все виды сальмонелл, имеющие общую так
называемую групповую фракцию
0-антигена, объединены в одну группу.
Таких групп в настоящее время насчитывается
около 65. S.typhiи
некоторые другие сальмонеллы имеют
Vi—антиген
(разновидность К-антигена), с этим
антигеном связывают вирулентность
бактерий, их устойчивость к фагоцитозу.
Факторы патогенности.
Сальмонеллы образуют эндотоксин,
обладающий энтеротропным, нейротропным
и пирогенным действием. С белками
наружной мембраны связаны адгезивные
свойства, наличие микрокапсулы
обусловливает устойчивость к фагоцитозу.
Резистентность.
Сальмонеллы довольно устойчивы к низкой
т-ре. Очень чувствительны к дезинфицирующим
веществам, высокой температуре,
ультрафиолетовым лучам. В пищевых
продуктах (мясе, молоке) сальмонеллы
могут не только долго сохраняться, но
и размножаться.
Эпидемиология.
Брюшной тиф и паратиф А
—
антропонозные инфекции; источником
заболевания являются больные люди и
бактерионосители. Источником паратифа
В
могут
быть также сельскохозяйственные
животные. Механизм заражения
фекально-оральный. Среди путей передачи
преобладает водный.
Патогенез.
Возбудители попадают в организм через
рот, достигают тонкой кишки, где в ее
лимфатических образованиях размножаются
и затем попадают в кровь (стадия
бактериемии). С током крови они разносятся
по всему организму, внедряясь в
паренхиматозные органы (селезенку,
печень, почки, костный мозг). При гибели
бактерий освобождается эндотоксин,
вызывающий интоксикацию. Из желчного
пузыря, где С. могут длительно сохраняться,
они вновь попадают в те же лимфатические
образования тонкой кишки. В результате
повторного поступления С. может развиться
аллергическая реакция, проявляющаяся
в виде воспаления, а затем некроза
лимфатических образований. Сальмонеллы
выводятся из организма с мочой и калом.
Клиника.
Клинически брюшной тиф и паратифы
неразличимы. Инкубационный период
составляет 12 дней. Болезнь начинается
остро: с повышения температуры тела,
появления слабости, утомляемости;
нарушаются сон и аппетит. Для брюшного
тифа характерны помутнение сознания,
бред, галлюцинации, сыпь. Очень тяжелыми
осложнениями являются прободение стенки
кишки, перитонит, кишечное кровотечение,
возникающие в результате некроза
лимфатических образований тонкой кишки.
Иммунитет.
После перенесенной болезни иммунитет
прочный и продолжительный.
Микробиологическая
диагностика.Основной
метод диагностики — бактериологический:
посев
и выделение S.
typhi
из крови (гемокультура), фекалий
(копрокультура), мочи (урино-культура),
желчи, костного мозга. РИФ для обнаружения
антигена возбудителя в биологических
жидкостях. Серологический
метод обнаружения
0- и Н- антител в РПГА. Бактерионосителей
выявляют по обнаружению Vi-антител
в сыворотке крови с помощью РПГА и
положительному результату
бактериологического; выделения
возбудителя. Для внутривидовой
идентификации применяют фаготипирование.
Лечение.
Антибиотики. Иммуноантибиотикотерапия.
Профилактика.
Санитарно-гигиенические мероприятия.
Вакцинация — брюшнотифозная химическая
и брюшно-тифозная спиртовая вакцина,
обогащенная Vi-антигеном.
Для экстренной профилактики —
брюшнотифозный бактериофаг.
Применяемое оборудование
При исследовании используется такое оборудования:
- банки с широким горлышком;
- стеклянные воронки;
- конусовидные колбы;
- колбы вместе с тубусом;
- стеклянные флаконы;
- лабораторная посуда;
- пипетки;
- цилиндры;
- бактериологические пробирки;
- спиртовки;
- лабораторные стаканы;
- покровные и предметные стекла;
- бактериологические чаши;
- пробирные поплавки;
- электрический автоклав;
- фильтровальные аппараты;
- кристаллизаторы;
- вакуумный насос;
- лабораторные весы.
Для анализа также используется водоструйный насос. Применяется его лабораторный вариант, выполненный из стекла. Используется водяная баня. Обязательным элементом является биологический микроскоп.
Применяются также:
- осветители;
- металлические пеналы;
- сигнальные часы;
- сетчатые пластины;
- увеличительные лупы;
- pH-метры (для измерения кислотности);
- дистилляторы.
Дополнительно используются:
- электрические термостаты, они предназначены для выращивания микроорганизмов при определенной температуре.
- счетный прибор для измерения выращенных колоний бактерий и сушильные шкафы.
Обязательным элементом являются холодильники. Используются как электрические, так и газовые с температурным режимом от 4С до 6С. Могут применяться походные сумки-холодильники, если бактериологический анализ проводится в полевых условиях.
Последовательность действий и особенности методики
Для проведения бактериологического исследования необходимо выполнить сбор материала и культивировать его на питательных средах с последующей микроскопией полученных штаммов и проверкой чувствительности к антибиотикам.
Сбор материала
Биоматериалом для исследования могут служить кровь, моча, ликвор, мокрота, сперма, кал, мазки из глотки, влагалища, уретры, любые другие ткани и жидкости из области инфекционного процесса. Образцы собирают в асептических условиях, помещают в стерильную посуду и в течение 2-х часов доставляют в лабораторию. При необходимости пробы хранят при пониженных температурах.
Культивирование
Культивирование проводят с применением механических или биологических методов. Механический подход с использованием стандартных искусственных сред – наиболее распространенный. В данном случае для высевания образцов используют жидкие и твердые питательные составы. Наиболее распространенные – агар, мясо-пептонный бульон.
Посев материала производят с помощью специальной петли или пастеровской пипетки, растирая полученный образец по поверхности или вводя его в толщу питательной среды. Выделение бактерий производят из чистых культур, которые получают повторным посевом ранее выращенных колоний на новую среду.
Биологические методы подразумевают использование специальных питательных сред, которые учитывают особенности микроорганизма, в частности, чувствительность к некоторым химическим веществам, в том числе антибиотикам. В некоторых случаях применяют метод заражения лабораторных животных или тканевых культур с отслеживанием патологических изменений. Такой подход актуален при крайне незначительном накоплении микроба в тканях человека – в этом случае его выделение посевом на питательных средах не дает результата.
Микроскопическое исследование
Основной метод бактериологической диагностики – бактериоскопия. Она подразумевает визуальную оценку параметров микроорганизма под микроскопом. Для этого используют фиксированные и нефиксированные препараты.
Нефиксированные препараты позволяют исследовать живые образцы бактерий. Основные методы:
- раздавленная капля – образец придавливают между предметным и покровным стеклами;
- висячая капля – образец помещают в лунку на предметном стекле и герметично накрывают покровным.В качестве среды используют изотонический раствор или расплавленный агар. Методика позволяет наблюдать за живыми микроорганизмами в течение нескольких дней.
Фиксированные препараты используют для окрашивания с подробным изучением морфологических и некоторых биохимических параметров патогенов. Каплю бактериального состава размазывают по предметному стеклу и фиксируют пламенем горелки или специальными химическими составами.
Для определения свойств бактериальных препаратов используют ряд общих и специфических методик:
- микроскопия – определение формы, размеров, окрашивания по Граму;
- биохимические методы – исследование ферментативной способности микроорганизма к расщеплению тех или иных углеводов, аминокислот, метаболитов, в том числе способность к гемолизу, фибринолизу при попадании в кровь живых существ;
- серологические методы идентификации – реакции агглютинации под воздействием специфической сыворотки и другие антигенные свойства;
- биологические методы – заражение лабораторных ждивотных с проверкой патогенности и токсигенности взятых образцов, их устойчивости к антибиотикам.
Только совокупный анализ результатов всех методов диагностики – микроскопических, биохимических, серологических, биологических – дает объективный результат для вынесения точного диагноза.
Забор и транспортировка
Для проведения исследования требуется правильно подготовить воду. Ее забор делается по схеме:
- Берется только стерильная бутылка.
- Водопроводный кран, откуда будет делаться забор воды, предварительно обжигается.
- Из крана на протяжении 7-10 минут должна сливаться вода. Только после этого ее можно набирать в стерильную емкость.
- Тара наполовину набирается водой, закрывается пробкой и перевозится в лабораторию. При этом вода при доставке к месту анализа не должна контактировать со стерильной пробкой.
Для исследования подходит только та вода, с момента забора которой прошло не больше 1,5 часа.
Сам анализ проводится по следующему плану:
- Осуществляют подготовку лабораторной посуды и всех материалов. Вся посуда стерилизуется, промывается и тщательно сушится. Стерилизация происходит в сушильном шкафу. Температура внутри него должна быть порядка 160-165С. Посуда обрабатывается сухим жаром на протяжении часа. Вместо сушильного шкафа может применяться автоклав. В нем температура ниже – порядка 126С. Обработка длится полчаса.
- Простерилизованную посуду вынимают из шкафа только после того, когда он остынет до температурных значений меньше 60С.
- Обработанную посуду помещают в лабораторные шкафы. Они должны плотно закрываться.
- Готовят стерильную воду. Сначала исследуемая вода разливается по флаконам, которые закрываются пробками. После этого флаконы с водой стерилизуются в автоклаве в течение 20 минут при температуре 120С. Такая вода пригодна для использования в течение 2 недель.
- Готовят питательную среду. Ее компонентами может быть как мясной бульон, так и глюкоза, лактоза или фильтрованная желчь скота.
- Готовят химические реактивы для конкретного анализа.
- Подготовленную питательную среду ставят на водяную баню, после чего охлаждают до 45-50С.
- Расставляют стерильные чаши с пометками.
- Берут несколько проб питательной среды и делают два посева в стерильные чаши.
- Колбы со взятой для анализа воды открывают, обжигают их горлышки и немного продувают их воздухом через пипетку. Она должна быть стерильной.
- Чистой палочкой делается забор воды. Она добавляется в стерильные чаши, которые закрываются пробкой.
- Взятая вода заливается остуженным питательным раствором. Чаша со смесью быстро перемешивается вращательными движениями. Далее чаша ставится на ровную поверхность. Смесь внутри нее должна застыть.
- Чаша с застывшим раствором переворачивается вверх дном и ставится в термостат. Там создается оптимальная среда для выращивания посевов (37С). Чаша находится в термостате сутки.
- Чаша с выращенными колониями микроорганизмов кладется на затемненный фон вверх дном. При помощи лупы делается подсчет количества появившихся колоний бактерий. При подсчетах учитывается число микроорганизмов на 1 см3 взятой для анализа воды.
- Результаты фиксируются в протоколе и регистрационном журнале. Дополнительно фиксируются особые условия, при которых проходил анализ.
Расшифровка результатов
Стандартный результат сводится к двум пунктам анализа:
- качественный анализ с определением факта наличия/отсутствия определенного возбудителя;
- количественный анализ с указанием числа микроорганизмов на единицу объема – выражают в КОЕ (колониеобразующие единицы). Чем выше этот показатель, тем сильнее бактериальное поражение организма данным возбудителем.
Внимание! Отрицательный результат является относительным и показывает отсутствие патогенных организмов лишь в отдельно взятой порции материала. Для большей объективности данных требуется повторное обследование
Дополнительно указывают чувствительность микроорганизмов к основным классам антибактериальных средств – пенициллинам, тетрациклинам, цефалоспоринам, макролидам. Чем выше показатель чувствительности, тем успешнее будет лечение данным антибиотиком.
Методы окраски образца
Окрашивание может быть простым, с использованием одного красителя. И сложным, при котором с целью точной дифференциации клеток бактерий по тем или иным их характерным признакам последовательно наносятся на образец несколько различных окрашивающих химических реагентов. Примером сложного окрашивания может служить методы Грама и Циля-Нильсена.
Метод Грама
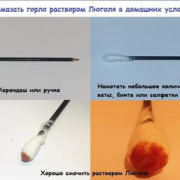
Метод Грама позволяет определить химический состав клеточной мембраны. Благодаря этому методу была введена классификация бактерий по Граму: грамположительные бактерии (к которым относятся возбудители многих болезней) после окраски приобретают темно-фиолетовый цвет, а грамотрицательные – характерный красный оттенок. Метод Грама состоит из следующих этапов:
- Сначала препарат обрабатывают раствором Люголя на протяжении одной минуты.
- После обработки люголем образец обесцвечивают с помощью спирта.
- Затем препарат промывают дистиллированной водой и дополнительно окрашивают фуксином.
Метод Циля-Нильсена
Метод Циля-Нильсена применяется для определения кислоточувствительных бактерий, в клеточных мембранах которых содержится большое количество липидов, к примеру, возбудителей туберкулеза. Работа по данному методу проводится в пять этапов:
- На предметное стекло накладывают фильтровальную бумагу, на которую затем наносят небольшое количество фуксина Циля.
- Затем предметное стекло нагревают до появления характерного пара. После появления пара стеклу дают остыть. Данную процедуру повторяют еще два раза, после чего снова дают остыть стеклу.
- После этого дистиллированной водой смывают фуксин с приборного стекла, предварительно убрав бумагу.
- Затем стекло помещают в раствор соляной или серной кислоты до полной утраты образцом цвета.
- Наконец, на обесцвеченный препарат наносят раствор метиленового синего, стекло промывают дистиллированной водой и дают ему высохнуть для дальнейшего рассмотрения получившегося препарата под микроскопом.
Метод Леффлера
В число простых методов окрашивания входит метод Леффлера. При нем все бактерии приобретают синий цвет. Работа по данному методу проводится в два шага:
- На мазок кладется фильтровальная бумага, на которую наносится раствор метиленового синего Леффлера. В таком состоянии препарат оставляется на 3-5 минут.
- По прошествии данного промежутка времени препарат промывается водой и высушивается, после чего его можно исследовать под микроскопом.
Современные методы бактериологического исследования
Все бактериологические исследования можно разделить на две группы в зависимости от того, каков предполагаемый результат.
I. Исследуемый объект должен быть стерилен.
В такой ситуации обнаружение любого микроорганизма является поводом для серьезного беспокойства. О чем идет речь? О крови, моче, материнском молоке, спинномозговой жидкости. Принципиально другой вопрос состоит в том, что взять для бактериологического исследования мочу или молоко и не нарушить при этом стерильности — очень сложно и практически невозможно в амбулаторных условиях. Неудивительно, что к положительным результатам, когда в моче или молоке обнаруживается некая бактерия, врачи часто относятся с определенной (весьма значительной) долей скепсиса. Никогда не бывает стопроцентной уверенности в том, что этот микроб действительно живет в молоке, а не попал туда с поверхности кожи, действительно живет в моче, а не на слизистой оболочке мочеиспускательного канала.
II. Для исследования берется заведомо нестерильный материал.
Всегда, когда изучается нечто, находящееся в контакте с окружающей средой, это нечто содержит бактерии. Любые мазки со слизистых оболочек, любые современные исследования слизи, мокроты, кала в обязательном порядке заканчиваются тем, что будет найдено определенное количество самых разнообразных микробов. Обнаруженные микробы по-разному взаимодействуют с человеческим организмом. Это позволяет выделить три группы бактерий:
1.
Бактерии нормальные, мирные, безвредные или даже полезные, являющиеся естественными обитателями исследуемой среды;
2.
Бактерии опасные, с большой долей вероятности способные вызвать болезнь — патогенные. Их обнаружение — тревожный сигнал, повод к углубленному обследованию, лечению;
3.
Бактерии условно-патогенные — бактерии, мирно сосуществующие с организмом человека, но потенциально опасные, способные вызвать болезнь при определенных обстоятельствах, которые в большинстве случаев возникают тогда, когда ослабевает иммунная защита организма ребенка.
Алгоритм бактериологического исследования
Узнать имя микроба — это далеко не все, хотя и очень важно. Ведь обнаружить некую бактерию — например, в мазке из носа золотистый стафилококк — вовсе не значит доказать, что именно он является причиной насморка: вполне возможно, что стафилококк живет себе мирно в носоглотке, а насморк вирусный или аллергический
Как же разобраться?
Во-первых, понимать, что любые бактериологические исследования — это дополнительная диагностика, а основная диагностика — это реальные жалобы и симптомы.
Во-вторых, следует знать, что современные культуральные методы бактериологической диагностики позволяют не только обнаружить микроб, но и определить, какое количество бактерий присутствует во взятом для исследования материале. В результате мы получим из лаборатории бланк бактериологического исследования, в котором увидим не только имя бактерии, но и ее концентрацию. Выглядит это примерно так: «Обнаружен S. aureus 106», что означает: обнаружен золотистый стафилококк в концентрации 106 микробных клеток на миллилитр (м.к./мл).
Выявив рост бактерий, можно ответить на вопрос, к каким антибактериальным средствам (антибиотикам) они (бактерии) чувствительны. Для этого в питательную среду добавляют различные современные препараты и оценивают, прекращается ли размножение микробов. Прекращается — значит, бактерия чувствительна к данному антибиотику, не прекращается — устойчива.
Бактериоскопический метод исследования
Клетки микроорганизмов
можно изучать как в живом состоянии
(метод раздавленной капли и метод висячей
капли), так и в фиксированном и окрашенном
состоянии.
Метод раздавленной
капли. На
поверхность обезжиренного предметного
стекла наносят каплю исследуемого
материала или суспензию бактерий и
покрывают ее покровным стеклом. Капля
не должна выходить за края покровного
стекла. Микроскопируют препарат с
объективом х40. Метод раздавленной капли
удобен для исследования подвижности
бактериальных клеток, а также для
изучения крупных микроорганизмов —
плесневых грибов, дрожжей.
Метод висячей
капли.
Препарат готовят на покровном стекле,
в центр которого наносят каплю
бактериальной суспензии. Затем специальное
предметное стекло с лункой, края которой
предварительно смазаны вазелином,
прижимают к покровному стеклу так, чтобы
капля находилась в центре лунки. Препарат
переворачивают покровным стеклом вверх.
В правильно приготовленном препарате
капля должна свободно висеть над лункой,
не касаясь ее дна или краев. Для микроскопии
используют вначале сухой объектив х8,
под увеличением которого находят края
капли, а затем устанавливают объектив
х40 и исследуют препарат.
Приготовление
фиксированных препаратов.
Для приготовления препарата на
обезжиренное предметное стекло наносят
каплю воды или изотонического раствора
хлорида натрия, в которую бактериологической
петлей вносят исследуемый материал и
круговыми движениями петли распределяют
его таким образом, чтобы получить тонкий
и равномерный мазок диаметром 1-1,5 см.
Если исследуют жидкий материал, то его
наносят на предметное стекло непосредственно
петлей и готовят мазок. Мазки высушивают
на воздухе.
Для фиксации
используют физические и химические
методы. Для фиксации мазка физическим
методом предметное стекло медленно
проводят 3 раза через пламя горелки.
Мазки крови, мазки-отпечатки органов и
тканей фиксируют химическим методом
путем погружения их на 5-20 минут в
метиловый или этиловый спирт, смесь
Никифорова и другие фиксирующие жидкости.
Для окрашивания
микробов используют простые и сложные
методы. При простом методе фиксированный
мазок окрашивают каким-либо одним
красителем, например, водным раствором
фуксина (1-2 минуты) или метиленовым синим
(3-5 минут), промывают водой, высушивают
и микроскопируют. Сложные методы
окрашивания включают последовательное
использование нескольких красителей.
Это позволяет выявить определенные
структуры клеток и дифференцировать
одни виды микроорганизмов от других.
Ход исследования
Исследовать культуру можно как в первозданном, так и в окрашенном виде. В последнем случае как колонии микроорганизмов, так и одиночные бактерии будут мертвы, что позволяет лучше ознакомиться со строением этих простейших организмов. При исследовании препарата в его первозданном виде, в свою очередь, лаборант получает больше информации об активности микробов. В обоих случаях препарат рассматривается при помощи микроскопа.
Окрашивание среды проводится в два этапа, сначала препарат подготавливают к процедуре и только затем его окрашивают. Подготовка образца проходит следующим образом:
- Образец, предназначенный для исследования, равномерно распределяется по приборному стеклу в форме круга или овала. При наличии в материале посторонних примесей (к примеру, гноя) перед добавлением исследуемого образца на стекло наносится 1-2 капли воды.
- После этого получившийся мазок следует высушить.
- Как только мазок высохнет, его необходимо зафиксировать с помощью пламени из горелки.
По окончании данной процедуры проводится окрашивание образца.
Организация процесса бактериологических исследований
На сегодняшний день развитие бактериологических исследований позволило выработать два типа организации процесса:
-
Исследуемый объект стерилен. В этой ситуации обнаружение любого объекта является поводом для беспокойства и обращения в медицинское учреждение. Такой результат может быть получен при исследовании крови, мочи. Правила стерильности достаточно просто нарушить в амбулаторных условиях. Поэтому если бактерии увеличены не значительно, то пациенту назначают повторный анализ с целью отслеживания динамики развития микроорганизмов. Нельзя быть полностью уверенным в том, что объект действительно живет в исследуемом материале, поскольку он мог быть занесен в среду с поверхности кожи;
-
Для бактериологического исследования берется заведомо нестерильный материал. Если изучается объект, который контактирует с окружающей средой, то в нем всегда содержится некоторое количество бактерий. Любой тип мазков со слизистых оболочек, анализ мокроты и кала заканчивается тем, что выявляется то или иное количество микробов. Они могут по-разному взаимодействовать с организмом и быть:
- нормальными, мирными, даже полезными;
- опасными и патогенными;
- условно – патогенными.
На сегодняшний день в междисциплинарной практике выработаны определенные принципы бактериологического исследования. Необходимо понимать, что бактериологическое исследование представляет собой дополнительную диагностику. Оно основывается на реальных жалобах и симптомах пациента.