Что означает резистентность к антибиотикам, и можно ли это исправить
Содержание:
- Поколения и резистентность
- Классификация антибиотиков
- Как бактерии становятся резистентными
- Сдерживание распространения антибиотикорезистентности
- Профилактика развития устойчивости к антибиотикам
- Что значит чувствительность к антибиотикам
- Пути преодоления антибиотикорезистентности
- Правила приема антибиотиков
- Почему антибиотик может быть неэффективным?
- Что такое резистентность?
- Что такое устойчивость к антибиотикам?
- Устойчивость к антибиотикам, содержащим бета-лактамное кольцо (к пенициллину, цефалоспорину)
Поколения и резистентность
Существует 4 поколения антибактериальных медикаментов. Последнее поколение демонстрирует наибольшую эффективность. В структуре противомикробных таблеток или уколов находится множество сложных элементов. Препараты 4 поколения обладают не только большей лекарственной эффективностью, но и менее токсичны для организма.
Средства последнего поколения принимаются меньшее количество раз в день. Эффект от их использования достигается гораздо быстрее. С их помощью возможно вылечить хроническое заболевание. Ингибирование ферментов микроба у современных препаратов очень высокая. При правильных действиях медикаменты последнего поколения будут эффективны несколько десятилетий.
В больницах часто назначают лекарства 3 и 4 поколения. Простые заболевания поддаются терапии при использовании препаратов 3 поколения. Они обладают большей токсичностью, но приобретаются в аптеке по более выгодной цене. Современное поколение не так широко распространенно и имеет стоимость выше, чем у более устаревших аналогов. Прием самого современного лекарства не всегда целесообразен. Пользоваться необходимо тем медикаментом, который оказывает нужный эффект. Если пренебрегать этим правилом, вызывается резистивность к современным лекарствам.
Пока еще микробы не имеют резистентность к антибиотикам последнего поколения. Хотя в условиях больниц и мест скопления различных патогенных микроорганизмов уже ходят слухи о том, что существуют невероятно устойчивые штаммы стафилококков и стрептококков. Со слов ученых антибиотикорезистентность способна развиваться бесконечно. Более того, об этом процессе было известно до появления первого антибиотика. Это глобальная проблема, так как создавать эффективные препараты все сложнее. Резистентность — особенность живых организмов. Это значит, что, в данный момент создать лекарство, к которому не будет привыкания — невозможно. Однако ученые двигаются в сторону изобретения идеального медикамента. Скорее всего, это будет абсолютно новый класс лекарств.
Принципы применения для предотвращения резистентности
От правильных действий человека зависит, как быстро микробы будут развиваться. Если будет вестись беспорядочный прием противомикробных медикаментов, в нужный момент лекарство просто не подействует. Любые антибиотики по механизму своего действия со временем вызывают резистентность.
Выделяют следующие правила приема антибиотиков:
- всегда заканчивать курс, даже если наступило улучшение;
- принимать медикамент по инструкции или рекомендациям врача;
- после приема проводить профилактику дисбактериоза;
- избегать самостоятельного назначения и использования антибактериальных препаратов.
Если соблюдать это, удастся повысить пользу от терапии и снизить частоту возникновения побочных эффектов. Если микробы будут уничтожены, то резистентность не передастся новым микроорганизмам. Стоит понимать, что соблюдение норм приема антибиотиков необходимо, чтобы при столкновении с серьезной болезнью (бактериальная пневмония, менингит) воздействовать на патогенные инфекции и возбудителей.
Классификация антибиотиков
Антибиотики – это группа антибактериальных препаратов, предназначенных для уничтожения или остановки размножения бактерий. Изначально антибиотики получали только естественным путем, сегодня существует огромное количество бактериостатиков, синтезированных в лабораториях (химиотерапевтические препараты). Из-за частой аллергии на пенициллин и устойчивости многочисленных бактериальных штаммов к его воздействию были разработаны различные группы антибиотиков без пенициллина.
Классификация антибиотиков
Есть несколько категорий, по которым можно классифицировать антибиотики. Первая делит их на натуральные и синтетические. Основным критерием разделения является химическая структура антибиотиков, основанная на их механизме действия против бактерий.
Существуют:
- бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы);
- пептидные антибиотики;
- аминогликозиды;
- тетрациклин;
- макролиды.
Макролиды, тетрациклины, карбапенемы, цефалоспорины 3-го, 4-го и 5-го поколений и некоторые пенициллины обладают очень широким спектром действия. Они борются с так называемыми грамположительными и грамотрицательными бактериями, а также нетипичными микроорганизмами.
Разделение бактерий в соответствии с методом Грама основано на структуре бактериальной клеточной стенки и результирующем цвете, в который бактериальная клетка окрашивает при просмотре под микроскопом.
Цефалоспорины второго поколения, монобактамы и аминогликозиды ингибируют (подавляют) пролиферацию главным образом грамотрицательных бактерий, а цефалоспорины первого поколения предотвращают синтез грамположительных клеток.
Как бактерии становятся резистентными
Один из таких механизмов – секреция ферментов, убивающих антибиотик. Самый известный из указанных ферментов — это бета-лактамаза. Это он «виноват» в том, что целый ряд разновидностей бактерий приобрел устойчивость к антибиотикам бета-лактамной структуры. Если в химической формуле препарата имеется бета-лактамное кольцо, выше означенный фермент его разрушает, и антибиотик теряет свою эффективность.
- Следующий сценарий формирования резистентности бактерий — изменение структур, с которыми вступает во взаимодействие медицинский препарат.
- И последний – активное удаление антибиотика из клетки бактерии. Указанный механизм был открыт не так давно, к нему имеют способность почти все бактерии.
Разработка нового поколения антибиотиков направлена в большой мере на преодоление указанных защитных бактериальных механизмов.
В этой связи особого внимания заслуживают две проблемы, которые спровоцировали значительный рост резистентности к антибиотикам.
- Первая проблема касается терапии острых бронхитов. В 90% случаев указанное заболевание провоцируют вирусы, а, значит, антибиотики в данном случае назначать не имеет смысла. Это не говорит о том, что антибиотики как таковые запрещено использовать при бронхите. Последние не должны выступать медикаментом ключевого выбора при терапии острого бронхита.
- Следующая проблема связана с новым методом терапии язвы желудка. Специалисты установили, что ключевым фактором в прогрессировании последней выступает бактерия Хеликобактер пилори (Helicobacter pylori). В связи с чем началась практика массированной терапии с подключением антибиотиков. В итоге, возникло значительное число бактерий, резистентных к медикаментозным препаратам.
Во Франции по указанной причине искусственные антибактериальные препараты – фторхинолоны — утратили эффективность при терапии воспаления легких.
В России против данной инфекции применяли антибиотики группы макролидов, но и к ним пневмококки приобрели резистентность. В последних рекомендациях для докторов по терапии пневмонии, снова вернулись к практике пенициллинов, которые продолжают сохранять результативность в борьбе с болезнью.
Меры, которые будут предприняты
На сегодняшний день на планете ежегодно по причине инфекций, спровоцированных микроорганизмами, устойчивыми к антибиотикам, умирает 700 000 человек.
Понятно, что бактерии, грибы, вирусы и прочие микроорганизмы не имеют границ к распространению. Значит, победить проблему резистентности к антибиотикам реально, объединив усилия разных государств.
Среди эффективных методов защиты людей от взрывного роста резистентных бактерий отмечается запрет на применение антибиотиков как стимуляторов роста в сельском хозяйстве (животноводстве) и подключение их в лечебных целях в данной отрасли народного хозяйства в исключительных моментах.
Пришло время задуматься о грамотном и рациональном применении противобактериальных препаратов в терапии населения.*опубликовано econet.ru.
Подборка видео МАТРИЦА ЗДОРОВЬЯ в нашем закрытом клубе
P.S. И помните, всего лишь изменяя свое потребление — мы вместе изменяем мир! econet
Сдерживание распространения антибиотикорезистентности
Антибиотики на сегодняшний день являются одной из самых часто применяющихся групп лекарственных средств. По данным Ассоциации международных фармацевтических производителей и ГК Ремедиум в 2014 году системные антибиотики в России занимали 4-е место в структуре амбулаторных и 2-е место в структуре госпитальных продаж готовых лекарственных средств.
Системные антибиотики в России, как и в большинстве развитых стран мира, относятся к лекарственным препаратам рецептурного отпуска, однако это требование далеко не всегда соблюдается. Недавнее исследование в рамках проводимой информационной кампании “Антибиотик надежное оружие, если цель бактериальная инфекция” показало, что 57% провизоров и фармацевтов аптечных учреждений Смоленска согласились продать антибиотик пациенту с симптомами острой респираторной инфекции без назначения врача. Более 60% опрошенных жителей Смоленска сообщили, что принимают антибиотики без назначения врача; у 38% опрошенных есть антибиотики в домашней аптечке. Таким образом, возможность свободного доступа стимулирует широкое использование антибиотиков населением для самолечения, что означает высокую вероятность их избыточного применения, ошибок при выборе препарата, дозы, длительности лечения.
В настоящее время во всем мире идет поиск альтернативных подходов к терапии инфекционных заболеваний. Одним из перспективных направлений в борьбе с инфекциями является применение бактериофагов и их компонентов. Бактериофаги природных штаммов и искусственно синтезированные генетически модифицированные фаги с новыми свойствами инфицируют и обезвреживают бактериальные клетки. Фаголизины – это ферменты, которые используются бактериофагами для разрушения клеточной стенки бактерий. Ожидается, что препараты на основе бактериофагов и фаголизинов позволят справиться с устойчивыми к АМП микроорганизмами, однако эти препараты появятся не ранее 2022-2023 гг. Параллельно с этим идет разработка препаратов на основе антибактериальных пептидов и вакцин для лечения инфекций, вызванных C. difficile, S. aureus, P. aeruginosa .
В последние годы резко возросла поддержка со стороны органов исполнительной и законодательной власти, а также Министерства здравоохранения Российской Федерации исследований, направленных на сдерживание антибиотикорезистентности. Так, например, Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) и Федеральный научно-методический центр мониторинга резистентности к антимикробным препаратам активно занимаются разработкой страте гических направлений по данной проблеме.
На международный уровень обсуждение данной проблемы вышло на рубеже веков. В 2001 году ВОЗ опубликовала Глобальную стратегию по сдерживанию устойчивости к противомикробным препаратам, а в 2016 году вопрос борьбы с растущей угрозой антибиотикорезистентности был вынесен на повестку дня Генеральной Ассамблеи ООН.
Входящие в ООН государства в совместном заявлении обязались разработать национальные планы мер по противодействию устойчивости микроорганизмов к АМП. Это подразумевает усиление мониторинга лекарственноустойчивых инфекций и контроля за применением АМП в медицине, ветеринарии и сельском хозяйстве, а также укрепление международного сотрудничества и финансирования. Также члены организации взяли на себя обязательства ужесточить законодательное регулирование применения АМП, заниматься поиском рационального их использования (улучшение диагностики инфекций с учетом их чувствительности к препаратам) и широко внедрять меры профилактики инфекционных заболеваний (вакцинация, очистка воды, санитария, должный уровень гигиены в стационарах и на фермах) .
Профилактика развития устойчивости к антибиотикам
С проблемой устойчивости сталкиваются как в амбулаторной практике, так и в стационарах. Так как использование антибиотиков неизбежно, проблема устойчивости будет существовать всегда.
В последние десятилетия было разработано мало новых антибактериальных препаратов, которые не смогли решить проблему устойчивости микроорганизмов. Разработка новых лекарств занимает около 10 лет, следовательно, средствами фармакологии быстро решить вопрос не получится.
1. Развитие устойчивости можно предотвратить путем более редкого использования антибиотиков и профилактики распространения бактерий.
2. Следует точно ставить диагноз и назначать рекомендуемые лабораторные и рентгенологические исследования.
3. Антибиотики назначать только в случае необходимости с учетом рекомендуемых показаний (за исключением особых случаев).
4. Если антибиотики не назначены, за пациентом ведут тщательное наблюдение.
5. Строго соблюдать гигиену рук. После каждого контакта с пациентом обрабатывать руки антисептиком. Спиртовые дез. средства предпочтительнее, чем регулярное мытье рук с мылом. Но они неэффективны в отношении некоторых микроорганизмов, в частности, Clostridium difficile является самым характерным примером. Таким образом, мытье рук водой с мылом остается обязательным в стационарах и других медицинских учреждениях.
6. Распространение устойчивых бактерий зависит от уровня гигиены. В стационарах бактерии преимущественно передаются через руки персонала и пациентов. Во многих странах климат способствует быстрому размножению бактерий, что усугубляет проблему устойчивости.
7. Уровень гигиены должен повышаться особенно в амбулаторном звене, а также в школах, где распространение инфекций среди учеников носит эпидемический характер.
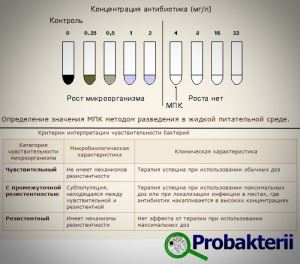
Что значит чувствительность к антибиотикам
В связи с ростом резистентности ко многим противомикробным средствам, определение чувствительности микроорганизмов к антибиотикам позволяет проводить противомикробную терапию максимально рационально и эффективно.
Итак, чувствительность к антибиотикам. Всех возбудителей инфекционно-воспалительных болезней можно разделить на:
- чувствительные;
- малочувствительные;
- полностью устойчивые.
Если рост и размножение бактерий на питательной среде подавляются терапевтическими дозировками антибиотиков, то бактерии считаются чувствительными. Малочувствительные штаммы, реагируют только на максимальные дозировки лекарственного средства.
Резистентными к антибиотику считаются патогены, которые ингибируются только критически высокими дозами антибактериальных средств, достичь которых можно исключительно в условиях лаборатории, но не в человеческом организме.
Как определить чувствительность к антибиотикам?
Этиотропное назначение противомикробных препаратов основывается на выделении возбудителя с дальнейшим определением чувствительности к антибиотикам. Этот анализ позволяет получить эпидемиологические показатели устойчивости патогенных микроорганизмов в определенном регионе, а также изучить структуру внутрибольничных и внебольничных инфекций.
При проведении пробы на чувствительность к антибиотикам, необходимо соблюдать определенный алгоритм действий и четко соблюдать все звенья бактериологической диагностики.
Этапность исследования состоит из:
- забора материала;
- доставки в лабораторию;
- посевов на специальные среды;
- выделения вида и штамма возбудителя;
- изучения чувствительности к противомикробным средствам.
Важно понимать, что достоверные данные анализа можно получить только при правильном выполнении всех этапов диагностики
Пути преодоления антибиотикорезистентности
Как бы ни был хорош тот или иной препарат, но при имеющемся у нас отношении к лечению, нельзя исключать тот факт, что в какой-то момент чувствительность патогенных микроорганизмов к нему может измениться. Создание новых препаратов с теми же действующими веществами тоже никак не решает проблему антибиотикорезистентности. Да и к новым поколениям препаратов чувствительность микроорганизмов при частых неоправданных или некорректных назначениях постепенно ослабевает.
Прорывом в этом плане считается изобретение комбинированных препаратов, которые называют защищенными. Их применение обосновано в отношении бактерий, продуцирующих разрушительные для обычных антибиотиков ферменты. Защита популярных антибиотиков осуществляется за счет включения в состав нового препарата специальных средств (например, ингибиторов ферментов, опасных для определенного вида АМП), которые купируют выработку этих ферментов бактериями и предотвращают выведение препарата из состава клетки посредством мембранного насоса.
В качестве ингибиторов бета-лактамаз принято использовать клавулановую кислоту или сульбактам. Их добавляют в бета-лактамным антибиотикам, благодаря чему повышается эффективность последних.
В настоящее время ведутся разработки препаратов, способных воздействовать не только на отдельно взятые бактерии, но и на те, которые объединились в группы. Борьбу с бактериями в составе биопленки можно вести лишь после ее разрушения и высвобождения организмов, прежде связанных между собой посредством химических сигналов. В плане возможности разрушения биопленки ученые рассматривают такой вид препаратов, как бактериофаги.
Борьба с другими бактериальными «группировками» ведется путем перенесения их в жидкую среду, где микроорганизмы начинают существовать раздельно, и теперь с ними можно бороться привычными препаратами.
Правила приема антибиотиков
Джуди Сметзер, вице-президент американского Института безопасной практики медикаментозного лечения, говорит о пяти основных правилах приема лекарств, которые следует учитывать также и при приеме антибиотиков: правильный пациент должен получать правильное лекарство в правильное время в правильной дозе и правильным способом применения.
Какие еще правила следует соблюдать при лечении антибиотиками?
Самое важное правило — проводить лечение до конца и не уменьшать назначенные врачом дозировки. По данным российских исследований, каждая четвертая мама не доводит курс антибиотиков, прописанных ее ребенку, до конца
В то же время затягивать прием на более длительный срок тоже нельзя — это дает дополнительный шанс инфекции найти способ борьбы с препаратом. Только «золотая середина» способна эффективно остановить инфекцию.
Антибиотики узкого спектра, то есть действующие на ограниченное число бактерий, безопаснее и предпочтительнее препаратов широкого спектра
Чем точнее воздействие, тем меньше шансов на выживание патогенных бактерий.
В идеале перед назначением антибиотиков следует пройти обследование на чувствительность к тем препаратам, которые будут назначены.
Особое внимание при лечении антибиотиками в больницах следует уделить риску заражения внутрибольничными инфекциями. Это значит, что санитарная обработка и дезинфекция должны проводиться на максимально доступном уровне.
-
Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. Смоленск, 2007.
-
US woman dies of infection resistant to all 26 available antibiotics // MedicalXpress. 13.01.2017. -
Scientists examine bacterium found 1,000 feet underground // Еurekalert.org/ 8.12.2016. -
MRSA-killing antibiotic produced by bacteria in the nose // UPI. 27.07.2016. -
Researchers may have found second ‘superbug’ gene in U.S. patient // Reuters. 27.06.2016.
Почему антибиотик может быть неэффективным?
Помимо описанного явления устойчивости бактерий к действию антибиотика, существует несколько причин, которые снижают эффективность препарата.
- Антибиотикотерапия неэффективна в борьбе с вирусами. Вирусные инфекции часто дают сходные с бактериальными заболеваниями симптомы. В случае сомнений причины болезни основанием для диагноза должно стать проведение лабораторных анализов, исключающих или подтверждающих бактериальную инфекцию. При вирусной этиологии антибиотики не помогут, так как они не борются с вирусами.
- Антибиотики широкого спектра действия снижают иммунитет. При бактериальном происхождении инфекции следует использовать соответствующий антибиотик. Но чаще всего врачи назначают антибиотики широкого спектра действия, например, амоксициллин, то есть те, которые борются с большинством бактерий. Эти препараты, в дополнение к несомненным преимуществам, имеют огромный недостаток – они также уничтожают здоровую бактериальную флору и, следовательно, ослабляют иммунитет.
- Разные бактерии лечатся разными антибиотиками. Несмотря на широкий спектр антибактериальной активности, вещество, содержащееся в антибиотике, может быть неэффективно в отношении возбудителя, вызвавшего инфекцию. Это частая ситуация при инфекциях, вызванных нетипичными бактериями или устойчивыми к определенной группе антибиотиков.
Чтобы исключить подобные ошибки и получить максимальный эффект от лечения антибиотиками, перед назначением препаратов врач должен направить пациента на анализы. После того как специалист убедится, что имеет дело с бактериями, ему потребуются результаты антибиотикограммы, показывающей, как конкретный возбудитель реагирует на разные препараты.
Что такое резистентность?
Резистентность — это устойчивость микроорганизмов к действию антибиотиков. В организме человека в совокупности всех микроорганизмов встречаются устойчивые к действию антибиотика особи, но их количество минимальное. Когда антибиотик начинает действовать, вся популяция клеток гибнет (бактерицидный эффект) или вовсе прекращает свое развитие (бактериостатический эффект). Устойчивые клетки к антибиотикам остаются и начинают активно размножаться. Такая предрасположенность передается по наследству.
В организме человека вырабатывается определенная чувствительность к действию определенного рода антибиотиков, а в некоторых случаях и полная замена звеньев обменных процессов, что дает возможность не реагировать микроорганизмам на действие антибиотика.
Также в некоторых случаях микроорганизмы и сами могут начать вырабатывать вещества, которые нейтрализуют действие вещества. Такой процесс носит название энзиматической инактивации антибиотиков.
Те микроорганизмы, которые имеют резистентность к определенному типу антибиотиков, могут, в свою очередь, иметь устойчивость к подобным классам веществ, схожих по механизму действия.
Что такое устойчивость к антибиотикам?
Представьте себе ситуацию, когда программист борется с хакером. Чем более совершенную антивирусную программу создаст ИТ-специалист, тем более сложные вирусы будет создавать хакер. После каждого нового вируса, который проник в систему и не был обнаружен и удален существующей антивирусной программой, ИТ-специалист должен подготовить улучшенный алгоритм. Когда на рынке появляется последняя антивирусная программа, хакеры уже начинают работать над другим вирусом, устойчивым к этой программе.
Устойчивость к антибиотикам – аналогичное явление, только оно возникает, когда бактерии приобретают устойчивость. Чем лучше и эффективнее антибиотик представлен на рынке, тем больше бактерий сосредоточено на изменении своих свойств, нейтрализующих свойства нового препарата. Так возникает устойчивость к антибиотикам.
С этой целью бактерии могут изменять свой генетический материал таким образом, что устойчивость к новому антибиотику становится их постоянной характеристикой, передаваемой будущим поколениям. Если с последующей серией лекарств, созданных учеными, бактерии приобретают устойчивость к воздействиям, то мутации в бактериальной ДНК накапливаются и образуют бактериальные штаммы, устойчивые практически к большинству антибиотиков. Этот процесс является основой бактериальной устойчивости к антибиотикам.
Устойчивость к антибиотикам
Устойчивость к антибиотикам, содержащим бета-лактамное кольцо (к пенициллину, цефалоспорину)
Устойчивость грамположительных бактерий к пенициллину обусловлена способностью бактерий синтезировать фермент, гидролизующий бета-лактамное кольцо, присутствующее в молекуле всех пенициллинов и в цефалоспорине. Этот фермент получил название бета-лактамазы или пенициллиназы.
Как показали исследования Новика (R. Novick, 1963), гены, контролирующие синтез пенициллиназы у Staphylococcus aureus, локализованы на нетрансмиссибельных плазмидах. В отличие от устойчивости к аминогликозидам, устойчивость к пенициллину у грамположительных бактерий, за исключением Вас. cereus, индуцибельна. Индукция синтеза пенициллиназы достигается присутствием в среде низких концентраций метициллина или оксациллина — препаратов, устойчивых к действию пенициллиназы. Напротив, у грамотрицательных бактерий синтез пенициллиназы конститутивен.
Грамотрицательные бактерии обычно менее чувствительны к пенициллину, чем грамположительные. Однако открытие и внедрение в клин, практику карбенициллин, ампициллина, цефалоспорина, активных против грамотрицательных бактерий, привело к быстрому появлению и широкому распространению устойчивых к пенициллину штаммов среди грамотрицательных бактерий и особенно среди энтеробактерий. Как и в случае грамположительных бактерий, у большинства грамотрицательных, выделенных из клин, материала, резистентность к пенициллину определяется присутствием в клетке R-плазмид, контролирующих синтез бета-лактамаз. Установлено, что бета-лактамазы, синтезируемые грамотрицательными бактериями, различны как по своим физ.-хим. свойствам, так и но субстратной специфичности. Существует по крайней мере 8 различных бета-лактамаз, которые по своим свойствам (субстратная специфичность, иммунологическая перекрестная реактивность, молекулярный вес, электрофоретическая подвижность при разных pH, чувствительность к р-меркурбензоату) группируются в четыре основные группы, обозначенные римскими цифрами (I, II, III, IV). Большинство известных R-плазмид контролирует синтез бета-лактамазы III группы. Уровень устойчивости бактерий к пенициллину не всегда является простой функцией количества фермента в бактерии. Он зависит также от таких параметров, как аффинитет фермента к субстрату, от локализации фермента в клетке, скорости проникновения антибиотика и др.