Респираторный дистресс-синдром новорожденных: чем опасен, принципы лечения, прогноз
Содержание:
- Возможна ли профилактика?
- Диагноз и рекомендуемые клинические исследования
- Лечение дистресс-синдрома
- Общие сведения
- Развитие респираторного дистресс синдрома
- Патогенез
- Что происходит?
- Этиология и патогенез
- Диагностика
- Патогенез рдсн
- Лечение
- Клиника и диагностика
- Лечение и прогноз
- Заместительная терапия экзогенными сурфактантами
- Диагностика
Возможна ли профилактика?
Доказано, что риск развития ДСН у детей, рожденных в положенный срок, крайне низок, а это значит, что для профилактики развития данного заболевания необходимо следить за течением беременности, вовремя посещать гинеколога, соблюдать принципы здорового образа жизни (отказаться от вредных привычек, скорректировать рацион, оберегать себя от стрессов и чрезмерных физических нагрузок, вовремя обнаружить и вылечить инфекционные заболевания).
Если существует риск развития преждевременных родов, будущая мама нуждается в госпитализации и проведении специальных терапевтических мероприятий, направленных на сохранение беременности.
ДСН – опасное заболевание, проявляющееся в виде проблем с дыханием, нарушением работы легких.
Данная патология чаще всего встречается у недоношенных детей, рожденных до 28 недели беременности.
Так же ДСН часто диагностируют у малышей, появившихся на свет позднее установленного срока. У доношенных детей риск развития патологии минимален, однако, если имеют место осложнения, возникающие в процессе родов, ребенок также может столкнуться с проблемой.
При обнаружении симптомов ДСН, ребенок нуждается в экстренной медицинской помощи, которая заключается в правильно подобранном медикаментозном лечении, процедурах, направленных на восстановление и стабилизацию дыхания.
Если ребенку вовремя не оказать помощь, возможно развитие серьезных последствий, вплоть до гибели малыша.
О причинах возникновения острого респираторного дистресс синдрома вы можете узнать из видео:
Диагноз и рекомендуемые клинические исследования
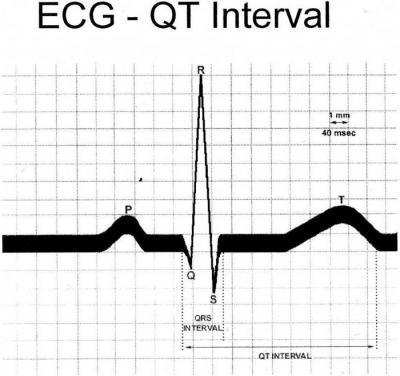
Для РДС характерна появляющаяся в первые 6 ч после родов триада рентгенологических признаков: диффузные очаги пониженной прозрачности, воздушная бронхограмма, уменьшение воздушности легочных полей.
Эти распространенные изменения наиболее отчетливо выявляются в нижних отделах и на верхушках легких. Помимо этого заметны уменьшение объема легких, кардиомегалия различной степени выраженности. Нодозно-ретикулярные изменения, отмечающиеся при рентгенологическом исследовании, по мнению большинства авторов, представляют собой рассеянные ателектазы.
Для отечно-геморрагического синдрома типичны «размытая» рентгенологическая картина и уменьшение размеров легочных полей, а клинически — выделение пенистой жидкости с примесью крови изо рта.
Если указанные признаки не выявляются при рентгенологическом исследовании спустя 8 ч после родов, то диагноз РДС представляется сомнительным.
Несмотря на неспецифичность рентгенологических признаков, проведение исследования необходимо для исключения состояний, при которых иногда требуется хирургическое вмешательство. Рентгенологические признаки РДС исчезают спустя 1—4 недели в зависимости от тяжести заболевания.
Рекомендуемые методы исследования:
■ рентгенологическое исследование грудной клетки;
■ определение показателей КОС и газов крови;
■ общий анализ крови с определением числа тромбоцитов и вычислением лейкоцитарного индекса интоксикации;
■ определение гематокрита;
■ биохимический анализ крови;
■ УЗИ головного мозга и внутренних органов;
Лечение дистресс-синдрома
Ребенку необходима интенсивная дыхательная терапия и ИВЛ. Прикасаться к малышу стоит по минимуму, выполняя лишь жизненно необходимые для него манипуляции. В случае недостатка сурфактанта, вещество вводится ребенку извне, что позволяет быстро улучшить  состояние малыша. Терапия искусственным сурфактантом требует участия только высокопрофессиональных медиков и ультрасовременного оборудования, так как такие детки очень сильно подвержены осложнениям. Малышу с подозрениями на респираторный дистресс-синдром срочно необходимо сделать рентген, чтобы выявить причину заболевания.
состояние малыша. Терапия искусственным сурфактантом требует участия только высокопрофессиональных медиков и ультрасовременного оборудования, так как такие детки очень сильно подвержены осложнениям. Малышу с подозрениями на респираторный дистресс-синдром срочно необходимо сделать рентген, чтобы выявить причину заболевания.
Общие сведения
Острый респираторный дистресс-синдром у взрослых (син. некардиогенный отек легких) представляет собой остро возникающее проявление дыхательной недостаточности, обусловленное диффузным воспалением паренхимы легких, которое развивается в виде неспецифической реакции на повреждающие агрессивные факторы различного генеза, приводящие к развитию некардиогенного отека легких с проявлением острой дыхательной недостаточности. Встречается острый респираторный дистресс-синдром (ОРДС) как у взрослых, так и у детей. Распространенность ОРДС колеблется в пределах 57-62 случая/100 тыс. населения/год, а показатели летальности зависят от этиологического фактора, тяжести течения/полиорганной недостаточности и могут варьировать от 16 до 82%.
В основе ОРДС взрослых, несмотря на его полиэтиологичность лежат патологические процессы, приводящие к повреждениям/изменению структур легочной ткани (альверно-капилярной мембраны), вызывающие нарушение проходимости мелких дыхательных путей и соответственно, несостоятельность транспортировки кислорода в легкие. Является частым осложнением различных заболеваний, отравлений, травм; наиболее часто ОРДС развивается при синдроме полиорганной недостаточности/системного воспалительного ответа. Быстро нарастающее снижение оксигенации/вентиляции организма вызывает развитие критических для жизни состояний, обусловленных кислородной недостаточностью головного мозга/сердца. Несмотря на существующую тенденцию к снижению показателей летальности, ОРДС остается важнейшей проблемой интенсивной терапии и современной пульмонологии. Респираторный дистресс синдром взрослых относится к критическим состояниям, требующим экстренной оценки состояния пациента и оказания неотложной помощи.
Респираторный дистресс синдром у детей (син. болезнь гиалиновых мембран, синдром дыхательных расстройств). Развивается у детей в первые дни жизни, то есть это патология новорожденных детей, обусловленная первичным нарушением образования (дефицитом) сурфактанта и функциональной/структурной незрелостью легких. Это способствует снижению эластичности ткани легкого, спаданию альвеол и развитию диффузных ателектазов, что проявляется резко выраженной дыхательной недостаточностью у ребенка уже в первые часы после рождения. Без немедленного лечения неизбежно развивается полиорганная недостаточность, приводящая к смерти ребенка.
Сурфактант представляет собой смесь поверхностно-активных веществ, покрывающих изнутри лёгочные альвеолы, основной функцией которых является недопущение спадения стенок альвеол за счет снижения поверхностного натяжения. В период внутриутробного развития плода синтез альвеолоцитами II типа сурфактанта начинается с 25-26 недели, но наиболее интенсивный процесс происходит начиная с 33-34 недели и на 35-36-й неделе гестации к моменту родов полностью завершается, что и способствует первичному расправлению легких. То есть, количество сурфактанта в легких обратно коррелирует с гестационным возрастом новорожденного. Созревание системы сурфактанта происходит под влиянием различных гормонов (кортизол, адреналин/норадреналин, гормоны щитовидной железы, эстрогены, катехоламины).
Синдром дыхательных расстройств у новорожденных — это самостоятельная нозологическая форма (МКБ-10: Р22.0). Иногда встречается термин этого заболевания «болезнь гиалиновых мембран» возникший по причине отложения гиалиноподобного вещества на внутренней поверхности альвеол/респираторных бронхиол. Частота возникновения возрастает по мере уменьшения гестационного возраста/массы тела ребенка при рождении.
Респираторный дистресс синдром новорожденных (РДС) относится к наиболее часто встречаемым/тяжелым заболеваниям недоношенных детей. На него приходится порядка 27% среди всех умерших детей, а у новорожденных детей, которые родились на 26-28 неделях гестации, этот показатель достигает 75%. Его встречаемость варьирует от 80 % у детей, рожденных на сроке гестации до 27 недель и 5-10% у рожденных на сроке гестации 35-36 недель. У доношенных детей синдром дыхательных расстройств возникает в 2-2,6% случаев и обусловлен преимущественно асфиксией в родах и морфофункциональной незрелостью ткани легких.
Развитие респираторного дистресс синдрома
У новорожденных с респираторным дистрессом проявления дыхательная недостаточность прогрессируют в ближайшие часы после рождения. Появляется цианоз при дыхании комнатным воздухом, постепенно нарастает тахипноэ с раздуванием крыльев носа и втяжениями уступчивых мест грудной клетки. Малыш становится вялым, принимает позу «лягушки». Стонущее дыхание и характерный «хрюкающий» выдох являются результатом попыток ребенка создать повышенное давление в дыхательных путях и поддержать легкие в расправленном состоянии. При аускультации легких выявляется ослабленное дыхание и крепитирующие хрипы. Нередко возникают приступы апноэ.
Частота сердечных сокращений обычно повышена, но при тяжелой гипоксии может наблюдаться брадикардия. Границы сердца у грудничка обычно расширены, могут выслушиваться сердечные шумы. Нарушения периферической микроциркуляции проявляются бледностью и понижением температуры кожных покровов.
При рентгенографическом исследовании органов грудной клетки отмечается характерная триада признаков: диффузное снижение прозрачности легочных полей, ретикулогранулярная сетчатость и наличие полосок просветлений в области корня легкого (воздушная бронхограмма). В тяжелых случаях отмечается тотальное затемнение легочных полей, границы сердца не дифференцируются.
У новорожденных детей, которым поставлен диагноз респираторный дистресс синдром необходимо определять газовый состав крови. Кроме того, в процессе оксигенотерапии должна непрерывно проводиться пульсоксиметрия и монитогинг дыхательных газов.
Определение гемоглобина и гематокрита, концентрации глюкозы и электролитов позволит уточнить объем и состав инфузионной терапии.
Эхокардиографическое исследование позволит исключить грубые врожденные пороки сердца, установить наличие, выраженность и направление шунтирования крови и назначить адекватную терапию.
До настоящего времени респираторный дистресс синдром остается наиболее частой причиной неонатальной смертности. Он развивается примерно у 20% недоношенных детей, а у новорожденных, родившихся до 28-й недели гестации, эта цифра достигает 80%.
Патогенез
Синдром начинается с повышения проницаемости легочных капилляров для белков, далее снижается градиент онкотического давления между плазмой и интерстициальной тканью, жидкость начинает поступать из плазмы крови в интерстициальную ткань. В этих условиях даже самое незначительное увеличение гидростатического давления в легочных капиллярах (вследствие инфузионной терапии и нарушения функции сердца) приводит к резкому усилению альвеолярного и интерстициального отек легких . В связи со значительной ролью повышения гидростатического давления изменения более выражены в нижележащих отделах легких. Происходит, с одной стороны, накопление в ткани легких жидкости, с другой — снижение объема альвеол.
Из-за повреждения альвеолоцитов II типа снижается продукция сурфактанта, изменяется его состав. Как следствие, транспульмональное давление, поддерживающее альвеолы в открытом состоянии, становится меньше их эластической тяги, развиваются ателектазы . Падает податливость легких.
В непораженных участках легких вентиляция и газообмен происходят относительно нормально. Поскольку вентиляторная и газообменная функции ложатся целиком на них, можно образно сказать, что функцию внешнего дыхания во взрослом организме обеспечивает пара детских легких.
Из-за снижения податливости легких дыхательные мускулатура на вдохе развивает большие усилие, в результате чего резко возрастает работа дыхания и развивается усталость дыхательных мышц. Гипоксемия и возбуждение механорецепторов обуславливают тахипноэ. Все это приводит к дальнейшему снижению дыхательного объема и ухудшению газообмена.
Из-за сужения бронхов, вызванного отеком и бронхоспазмом, уменьшается числа бронхов, по которым движется воздух, повышается сопротивление дыхательных путей. Легочное сосудистое сопротивление и давление в легочной артерии увеличиваются: сначала под влиянием нейрогуморальных факторов, позже — вследствие обструкции, окклюзии и перестройки легочных сосудов.
Газообмен харастеризуется снижением VA/Q , значительным внутрилегочным сбросом крови справа налево и увеличением мертвого пространства. Внутрилегочный сброс крови обусловлен ателектазами и ослаблением гипоксической вазоконстрикции, а объем мертвого пространства увеличивается из-за обструкции и окклюзии легочных капилляров.
Что происходит?
Недостаточно количество сурфактанта в легких недоношенного ребенка приводит к тому, что на выдохе лёгкие как бы захлопываются (спадаются) и ребёнку приходится при каждом вдохе их заново раздувать. Это требует больших затрат энергии, в результате силы новорожденного истощаются и развивается тяжёлая дыхательная недостаточность. В 1959 году американскими учеными М.Е. Avery и J. Mead была обнаружена недостаточность легочного сурфактанта у недоношенных новорожденных детей, страдающих респираторным дистресс-синдромом, таким образом и была установлена основная причина РДС. Частота развития РДС тем выше, чем меньше срок, на котором родился ребенок. Так, им страдают в среднем 60 процентов детей, родившихся при сроке беременности менее 28 недель, 15—20 процентов — при сроке 32—36 недель и всего 5 процентов — при сроке 37 недель и более.
Клиническая картина синдрома проявляется, прежде всего, симптомами дыхательной недостаточности, развивающимися, как правило, при рождении, или через 2-8 часов после родов — учащение дыхания, раздувание крыльев носа, втяжение межреберных промежутков, участие в акте дыхания вспомогательной дыхательной мускулатуры, развитие синюшности (цианоза). Из-за недостаточной вентиляции легких очень часто присоединяется вторичная инфекция, и пневмония у таких младенцев — отнюдь не редкость. Естественный процесс выздоровления начинается после 48-72 часов жизни, однако не у всех детей этот процесс идёт достаточно быстро — из-за развития упомянутых уже инфекционных осложнений.
При рациональном выхаживании и тщательном соблюдении протоколов лечения детей с РДС выживает до 90 процентов маленьких пациентов. Перенесенный респираторный дистресс-синдром в дальнейшем практически не отражается на состоянии здоровья детей.
Этиология и патогенез
Соматоформная дисфункция вегетативной нервной системы органов дыхания может быть обусловлена многочисленными причинами, такими как:
- органические заболевания нервной системы;
- психогенные заболевания;
- соматические факторы и заболевания, эндокриннометаболические нарушения, экзо- и эндогенные интоксикации.
Основные концепции генеза:
- расстройство рассматривается как проявление тревоги, страха и истерических расстройств;
- гипервентиляция — это результат сложных биохимических изменений в системе минерального (преимущественно кальция и магния) гомеостаза, обусловленных изменением характера питания и т. д., что приводит к дисбалансу систем дыхательных ферментов, проявляющемуся гипервентиляцией;
- в основе генеза — привычка неправильно дышать, что связано со многими факторами, в том числе культуральными.
В патогенезе ГВС наиболее важны нейрогенные механизмы
Диагностика
Пренатальная диагностика (прогнозирование риска развития РДСН) основана на исследовании липидного спектра околоплодных вод (в крупных специализированных стационарах и региональных перинатальных центрах). Наиболее информативны следующие методы.
1) Коэффициент соотношения лецитина к сфингомиелину (в норме >2). Если коэффициент менее 1, то вероятность развития РДСН около 75%. Коэффициент от 1 до 2 — вероятность развития РДСН 50%. У новорожденных от матерей с сахарным диабетом РДС может развиться при соотношении лецитина к сфингомиелину более 2,0.
2) Уровень насыщенного фосфатидилхолина (в норме более 5 мкмоль/л) или фосфатидилглицерина (в норме более 3 мкмоль/л). Отсутствие или резкое снижение концентрации насыщенного фосфатидилхолина и фосфатидилглицерина в амниотической жидкости свидетельствует о высокой вероятности развития РДСН.
Диагноз основывается на данных анамнеза (факторах риска), клинической картине, результатах рентгенологического исследования.
Дифференциальную диагностику проводят с сепсисом, пневмонией, транзиторным тахипноэ новорождённых, синдромом аспирации мекония.
Патогенез рдсн
При
преждевременных родах (до 36 недели
беременности) легкие незрелые, количество
сурфактанта недостаточно для полноценного
расправления альвеол. Это приводит к
образованию участков гиповентиляции
легких. Развивающаяся вследствие этого
гипоксемия и гипоксия приводят к
повреждению эндотелия легочных
капилляров, дальнейшему прогрессированию
дыхательной гипоксии и ацидоза. Как
следствие, увеличивается проницаемости
АКМ и жидкая часть крови пропотевает в
просвет альвеол. Также происходит
формирование гиалиновых
мембран
из белков крови и некротизированного
альвеолярного эпителия. Ателектазы и
гиалиновые мембраны приводят к образованию
альвеолярно-капиллярного блока —
значительному снижению или прекращению
диффузии О2
и СО2
через АКМ.
Лечение
Выбор терапевтических мероприятий будет зависеть от ситуации. Респираторный дистресс-синдром у новорожденных — это состояние, требующее проведения реанимационных мер, включающих обеспечение проходимости дыхательных путей и восстановаления нормального дыхания.
Сурфактантотерапия
Одним из эффективных методов лечения считается введение сурфактанта недоношенному ребенку в трахею в первый так называемый золотой час жизни. Например, используют препарат Куросурф, являющийся натуральным сурфактантом, полученным из легких свиньи.
Суть манипуляции заключается в следующем. Перед введением флакон с веществом нагревают до 37 градусов и переворачивают его вверх дном, стараясь не встряхивать. Данную суспензию набирают с помощью шприца с иглой и вводят в нижний отдел трахеи через интубационную трубку. После процедуры выполняется ручная вентиляция на протяжении 1-2 минут. При недостаточном эффекте или его отсутствии повторную дозу вводят спустя 6-12 часов.
Подобная терапия имеет неплохие результаты. Она повышает выживаемость новорожденных. Однако у процедуры есть противопоказания:
- артериальная гипотония;
- шоковое состояние;
- отек легких;
- легочное кровотечение;
- пониженная температура;
- декомпенсированный ацидоз.
 Один из препаратов сурфактанта
Один из препаратов сурфактанта
В таких критических ситуациях прежде всего необходимо стабилизировать состояние младенца, а потом уже приступать к лечению. Стоит отметить, что наиболее эффективные результаты сурфактантотерапия дает в первые часы жизни. Еще один недостаток — дороговизна препарата.
CPAP-терапия
Это метод создания постоянного положительного давления в респираторных путях. Применяется при легких формах РДС, тогда, когда только развиваются первые признаки дыхательной недостаточности (ДН).
ИВЛ
Если CPAP-терапия оказывается неэффективной, ребенка переводят на ИВЛ (искусственное вентилирование легких). Некоторые показания к ИВЛ:
- нарастающие приступы апноэ;
- судорожный синдром;
- оценка больше 5 баллов по Сильверману.
Необходимо учитывать, что применение ИВЛ в лечении детей неизбежно приводит к повреждению легких и таким осложнениям, как пневмонии. При проведении ИВЛ обязательно ведется мониторинг жизненных показателей и функционирования организма малыша.
Клиника и диагностика
Пренатальный диагноз основан на оценке
зрелости легких плода по фосфолипидному
составу околоплодной жидкости и оценке
уровня сурфактантного протеина А.
У новорожденного первым признаком
развивающегося СДР является одышка,
которая обычно появляется через 1-4 часа
после рождения. Одышка при СДР возникает
на фоне розовых кожных покровов, так
как имеется большое сродство фетального
гемоглобина к кислороду.
Экспираторные шумы обусловлены тем,
что на начальных этапах СДР в качестве
компенсаторного механизма развивается
спазм голосовой щели на выдохе,
способствующего увеличению остаточной
емкости легких и препятствующего
спадению альвеол.
Западение грудной клетки на выдохе –
третий по времени появления признак
СДР. Позднее возникает напряжение
крыльев носа, приступы апноэ, цианоз,
раздувание щек, ригидный сердечный
ритм, парадоксальное дыхание, пена у
рта, отек кистей и стоп, плоская грудная
клетка.
Аускультативно в первые часы жизни над
легкими выслушивается резко ослабленное
дыхание, далее на фоне ИВЛ – нормальные
дыхательные шумы, позднее – высокие
сухие хрипы на вдохе и выдохе, крепитирующие
и мелкопузырчатые хрипы.
Общие симптомы: температурная
нестабильность, вялость, бледность
движений, гипорефлексия, атрериальная
и мышечная гипотония, олигурия, срыгивания,
вздутие живота, периферические отеки,
большие потери первоначальной массы
тела. Нижние конечности часто находятся
в «позе лягушки». При прогрессировании
развиваются признаки шока и ДВС-синдрома.
Тяжесть дыхательных расстройств у
новорожденных оценивается по шкале
Сильвермана.
Шкала Сильвермана
|
Стадия 0 |
Стадия I |
Стадия II |
|
Верхняя часть грудной клетки и передняя
Отсутствие втяжения межреберий на
Отсутствие втяжения мечевидного
Отсутствие движения подбородка при Отсутствие шумов на выдохе. |
Отсутствие синхронности или минимальное Легкое втяжение межреберий на вдохе.
Небольшое втяжение мечевидного
Опускание подбородка на вдохе, рот
Экспираторные шумы слышны при |
Заметное западение верхней части Заметное втяжение межреберий на вдохе.
Заметное западение мечевидного
Опускание подбородка на вдохе, рот
Экспираторные шумы слышны при поднесении |
Примечание: каждый симптом в графе
«Стадия I» оценивается в 1 балл, в графе
«Стадия II» — в 2 балла.
Клиническая форма развития синдрома
дыхательных расстройств расценивается
как:
— крайне тяжелая при оценке по шкале
Сильвермана в 10 баллов
— тяжелая – 6-9 баллов
— средней тяжести – 5 баллов
— начинающийся СДР – менее 5 баллов
Осложнения у новорожденных с СДР
|
Системные осложнения |
Местные осложнения |
|
— незаращение артериального протока — септический шок — ДВС-синдром — внутрижелудочковые кровоизлияния — гипогликемия — транзиторная гипераммониемия — ядерная желтуха |
— синдром «утечки воздуха» — кровоизлияния в легкие — пневмонии — бронхолегочная дисплазия — связанные с интубацией: — поражения гортани — поражения трахеи |
Помимо клинических данных, для диагностики
СДР обязательно используют рентгенологическое
исследование грудой клетки. Характерна
триада симптомов:
— диффузные очаги пониженной прозрачности
— воздушная бронхограмма
— пониженная пневматизация легочных
полей в нижних отделах легких и на
верхушках
Мониторное наблюдение проводится за
всеми новорожденными с синдромом
дыхательных расстройств и включает:
— контроль частоты сердечных сокращений
и дыханий
— чрескожную оксигемоглобинометрию
— термометрия кожи живота каждые 3-4 часа,
определение артериального давления,
диуреза, КОС, уровня гликемии и концентрации
О2 во вдыхаемом воздухе
— Rg-графию грудной клетки (ежедневно в
острой фазе)
— проведение клинического анализа крови,
посева крови и содержимого трахеи,
определение гематокрита
— определение в сыворотке крови уровня
мочевины, калия, натрия, кальция и магния,
общего белка и альбуминов, осмолярность
крови.
Лечение и прогноз
Лечение респираторного дистресс синдрома новорожденных (РДСН) необходимо начинать как можно раньше. Современное лечение РДСН заключается в введении сурфактанта в трахею ребёнка в первые минуты жизни и использовании респираторной поддержки — СРАР терапии через назальные канюли. «Золотой» первый час жизни позволяет уменьшить тяжесть течения заболевания. Данная методика позволяет минимизировать инвалидизацию ребёнка, улучшает качество жизни.
Куросурф- натуральный сурфактант животного происхождения (добывается из лёгких свиней) для лечения и профилактики РДС у недоношенных новорожденных с доказанной высокой эффективностью и безопасностью. Начальная доза 200 мг/кг. При необходимости применяют дополнительные половинные дозы 100 мг/кг с интервалом 12 часов. При неэффективности респираторной СРАР — терапии показаниями для перевода на традиционную ИВЛ является дыхательный ацидоз: pH ниже 7,2 и pCO2 более 60 мм.рт.ст.; частые (более 4 в час) или глубокие (необходимость в масочной ИВЛ) 2 и более раз в час приступы апноэ. С целью стимуляции регулярного дыхания и предотвращения апноэ используют метилксантины: кофеин- бензоат натрия из расчета 20 мг/кг нагрузочная доза и 5 мг/кг поддерживающая доза каждые 12 часов капать под язык.
Созревание и функциональная способность легких являются критичными для выживания. Основываясь на степени недоношенности, легкие могут быть частично, или полностью незрелыми, и соответственно, не способными обеспечить адекватную дыхательную функцию из-за отсутствия или недостаточного количества, вырабатываемого сурфактанта. В таких ситуациях новорожденному показано проведение сурфактант-заместительной терапии.
Заместительная терапия экзогенными сурфактантами
К экзогенным сурфактантам относятся:
■ естественные — выделяют из околоплодных вод человека, а также из легких поросят или телят;
■ полусинтетические — получают путем смешивания измельченных легких крупного рогатого скота с поверхностными фосфолипидами;
■ синтетические.
Большинство неонатологов предпочитают использовать естественные сурфактанты. Их применение быстрее обеспечивает эффект, снижает частоту развития осложнений и уменьшает длительность ИВЛ:
Колфосцерила пальмитат эндотрахеально 5 мл/кг каждые 6—12 ч, но не более 3 раз или
Порактант альфа эндотрахеально 200 мг/кг однократно,
затем 100 мг/кг однократно (через 12—24 ч после первого введения), не более 3 раз или
Сурфактант БЛ эндотрахеально
75 мг/кг (растворить в 2,5 мл изотонического р-ра натрия хлорида) каждые 6—12 ч, но не больше 3 раз.
Сурфактант БЛ можно вводить через боковое отверстие специального адаптера эндотрахеальной трубки без разгерметизации дыхательного контура и прерывания ИВЛ. Общая продолжительность введения должна составлять не менее 30 и не более 90 мин (в последнем случае препарат вводят с помощью шприцевого насоса, капельно). Другой способ заключается в использовании распылителя ингаляционных растворов, вмонтированного в аппарат для ИВЛ; при этом длительность введения должна составлять 1—2 ч. В течение 6 ч после введения не следует проводить санацию трахеи. В дальнейшем препарат вводят при условии сохраняющейся потребности в проведении ИВЛ с концентрацией кислорода в воздушно-кислородной смеси более 40%; интервал между введениями должен быть не менее 6 ч.
Диагностика
Данное заболевание выявляется методом оценки клинических проявлений, а также на основании данных лабораторных исследований, таких как:
- анализ крови для определения уровня лейкоцитов;
- пульсоксиметрия для определения уровня кислорода в крови;
- анализ на содержание в крови других газов;
- бактериологический анализ крови;
- рентгенологические обследования легких.
Важно провести своевременный скрининг плода для дифференциации дистресс синдрома с другими заболеваниями, такими как:
- Временное учащение дыхания, которое нередко возникает у детей после кесарева сечения. Данная патология самостоятельно проходит с течением времени, не требует какого – либо специфического лечения.
- Заражение крови или врожденная пневмония. При данных заболеваниях у ребенка обнаруживаются воспалительные элементы в крови, а рентгенограмма показывает отчетливые темные пятна в легких.
- Аспирация меконием. Ребенок в процессе родов может вдохнуть меконий (первородный кал) что также приводит к нарушению дыхания. Однако, данная проблема имеет свои характерные симптомы, которые при ДСН не обнаруживаются.
- Повышение давления в области легких. При данной патологии отсутствуют симптомы, характерные для ДСН.
- Отсутствие или недостаточное развитие легких. Данный недуг обнаруживается методом УЗИ еще во внутриутробном периоде развития ребенка.
- Грыжа в области диафрагмы (смещение органов из брюшной полости в грудную) определяется при помощи рентгена в первые дни жизни ребенка.